Microscopio Olympus Fluoview 1000

Este microscopio confocal permite detectar fluorescencia en dos y tres canales simultáneamente visualizando también la luz transmitida con óptica DIC; permite realizar series en el plano Z para reconstrucciones 3D; captura de una secuencia en el tiempo para experimentos in vivo. Utiliza un microscopio invertido OLYMPUS IX81 con los siguientes objetivos:
10x NA 0.30 uplan FL N
20x NA 0.50 uplan FL N
40x NA 1.30 uplan FL N oil
60x NA 1.35 uplan Sapo oil
100x NA 1.40 uplan Sapo oil
Las unidades laser que posee son los siguientes:
Láser Gaseoso Multi Argón de 40 mW (458/488/515nm)
Láser Verde Helio Neón 543nm
Láser Rojo Helio Neón 633nm
Láser de estado sólido 440nm
El software Fluoview v 5.0 permite manejar fácilmente las diferentes capturas que se pueden realizar con este equipo.
| Microscopio | Sistema Olympus LSM Fluoview 1000, microscopio Olympus IX81 (invertido) |
| Objetivos | 10x NA 0.30 uplan FL N |
| 20x NA 0.50 uplan FL N | |
| 40x NA 1.30 uplan FL N oil | |
| 60x NA 1.35 uplanSapo oil | |
| 100x NA 1.4 uplan Sapo oil | |
| Detección | PMT |
| Software | Fluoview v 5.0 |
| Otros | rueda de filtros motorizada, rueda de objetivos motorizada en el plano Z |
| Deteccion de fluorescencia: Fuente de luz | Láser Gaseoso Multi Argón de 40 mW (458/488/515nm) |
| Láser Gaseoso Verde Helio Neón 543nm | |
| Láser Gaseoso Rojo Helio Neón 633nm | |
| Láser de estado sólido 440nm | |
| Filtro Exitación | DM 488/546/633 |
| BS 20/80 | |
| DM 405/488 | |
| DM 405-440/515 | |
| DM 405-440 | |
| Filtro Emisión Canal 1: | BA 465-495 |
| BA 505-525 | |
| BA 480-495 | |
| Filtro Emisión Canal 2: | BA 505 IF |
| BA 560-620 | |
| BA 535-565 | |
| BA 520-550 | |
| Filtro Emisión Canal 3: | BA 650 IF |
| BA 560 IF | |
-
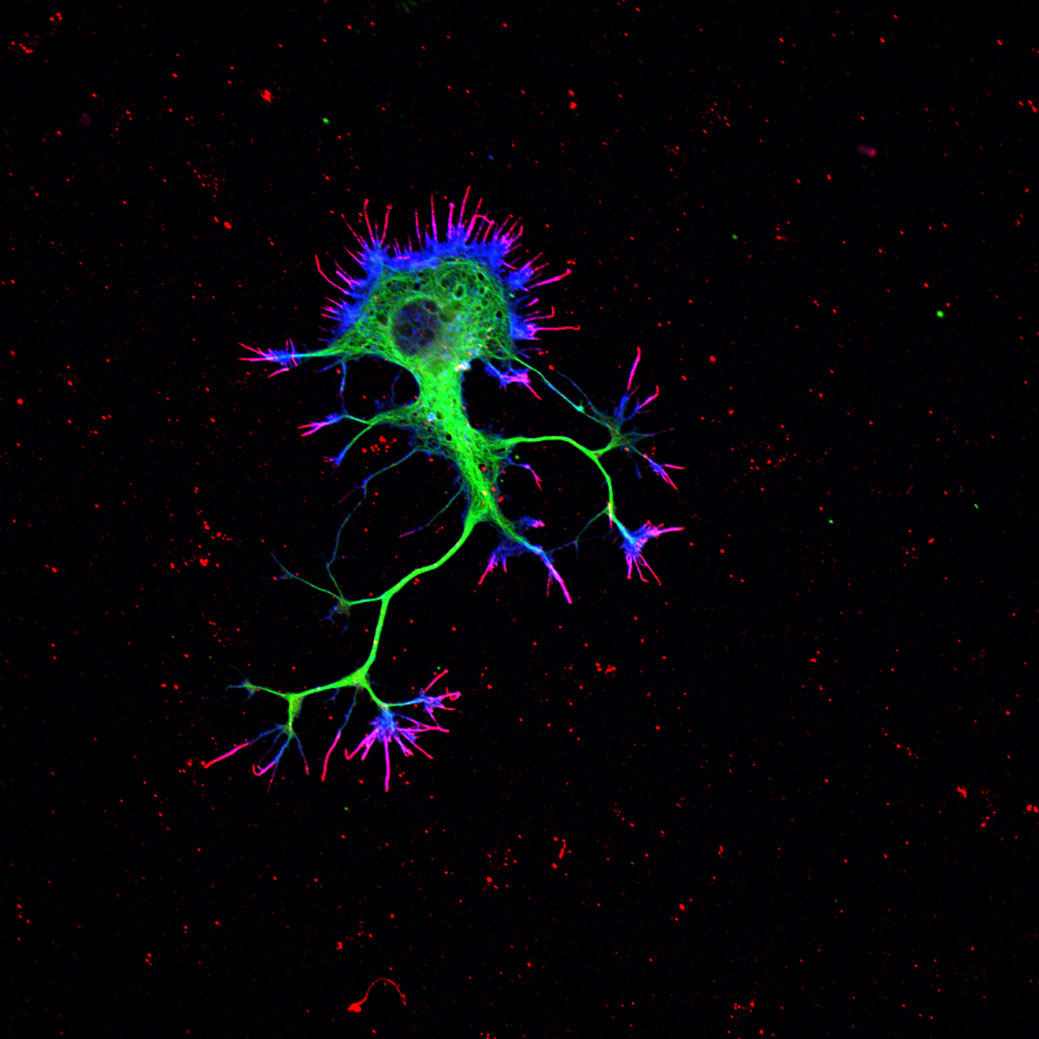
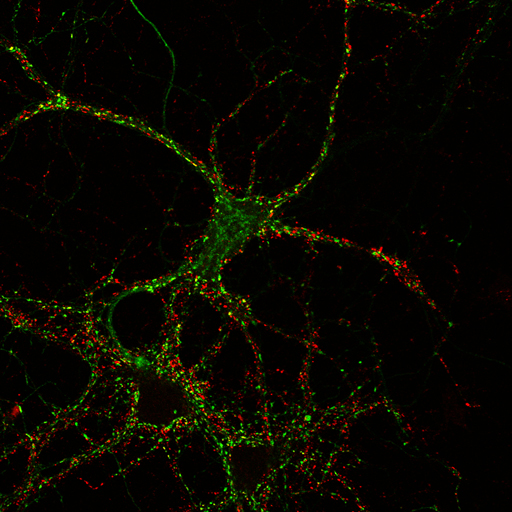
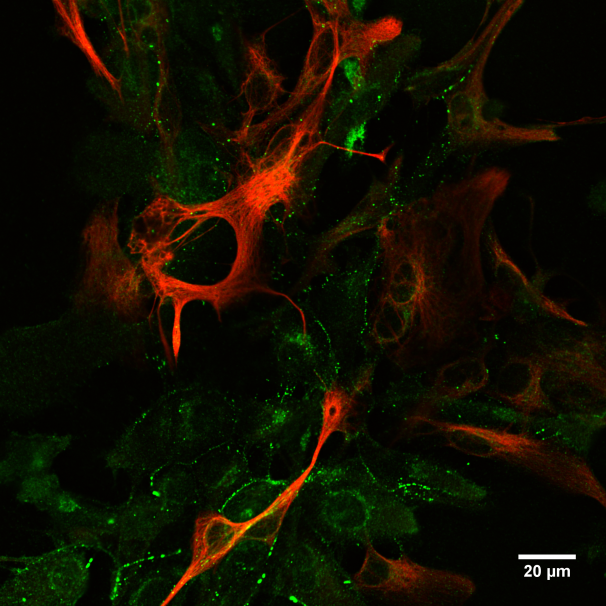
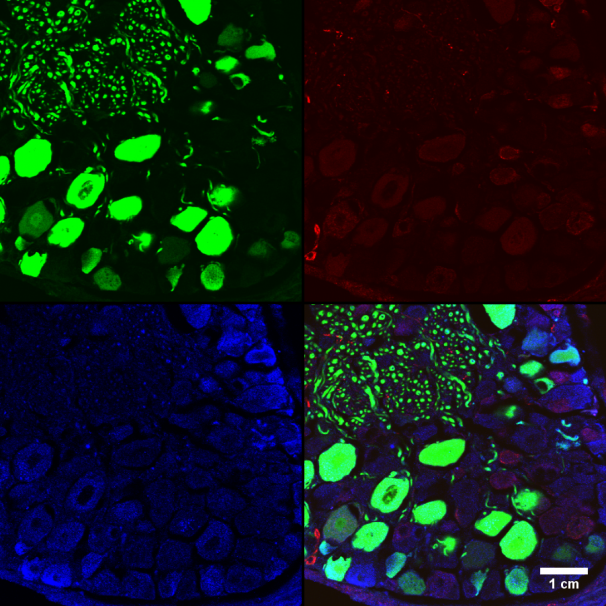
Observación de muestras teñidas con fluoróforos de longitud de onda definidos.
-
Observación de muestras teñidas con tinciones vitales fluorescentes (lysotracker, mitotracker, etc…)
-
Posibilidad de realizar cortes ópticos y de esta forma tener una serie de imágenes en el eje Z de la muestra, con posibilidades de realizar reconstrucciones 3D
-
Captura de 3 fluoróforos simultáneos
-
FRET (Fluorescence Resonance Energy Transfer) en células fijadas
-
Captura de imágenes DIC
-
Captura de imágenes con luz Polarizada