Microscopio Confocal con detector espectral Nikon y cuatro láseres de estado sólido a 405nm, 488nm, 561nm y 640nm con modulación de intensidad por medio de sistema AOTF. El sistema posee tres canales de fluorescencia con una velocidad de escaneo de 1 fps a 512×512 pixeles. El detector espectral posee 32 canales para trabajo a resoluciones de 2,5nm, 5nm y 10nm, y una velocidad de escaneo de 0,5 fps a 512×512 pixeles permitiendo separar aquellas marcas de fluoroforos muy cercanos.
El Microscopio confocal C2 está montado sobre una plataforma invertida motorizada modelo Eclipse Ti-E de Nikon con objetivos de 10x,20x,40x oil y 60x oil que incluye además el sistema de mantención del foco PFS (Perfect Focus Systems) para experimentos de time lapse .
Todas las funciones del equipo en su opción confocal normal y espectral son controladas por el Software NIS-Elements C de Nikon que es de fácil manejo y con una plataforma intuitiva, incluyendo herramientas de análisis y procesamiento de imágenes.
|
Microscopio
|
Nikon modelo Ti-E C2si (invertido) |
|
Objetivos
|
Plan Fluor 10x DIC L NA 0.3 |
|
|
Plan Apo VC 20x DIC N2 NA 0.75 |
|
|
Plan Apo 40x OIL DIC H NA 1.0 |
|
|
Plan Apo VC 60x OIL DIC N2 NA 1.4 |
|
Detección
|
PMT |
|
Software
|
NIS-Elements C de Nikon |
|
|
Placa de incubación con control de temperatura y CO2 |
|
Fuente de luz
|
Láser 638nm |
|
|
Láser 561nm |
|
|
Láser 488nm |
|
|
Láser 405nm |
|
Filtros
|
Cubo Em 445/35 (427 – 462nm) y 660nm Long Pass. Este cubo es para ser usado con los laser 405nm y 641nm (o 638). |
|
|
Cubo con Em 525/50 (500 – 550nm) y 600/50 (575 – 625nm). Este cubo es para ser usado con los laser 488nm y 561nm. |
|
Detector espectral
|
Posee 32 canales para trabajo a resoluciones de 2,5nm, 5nm y 10nm, y una velocidad de escaneo de 0,5 fps a 512x512 pixeles permitiendo separar aquellas marcas de fluoroforos muy cercanos |
-
Análisis de colocalización.
-
Inmunofluorescencia y detección de sondas.
-
Series en Z (z-stack) y reconstrucción 3D.
-
Time-lapse (series temporales) en celula viva.
-
Tecnica FRAP(Fluorescence Recovery After Photobleaching).
-
Tecnica FRET (Fluorescence Resonance Energy Transfer).
-
Determinación de espectros de fluorescencia.
-
Estudios de GFP sensible a ROS.
-
Visualización de GFP cuando esta marcando estructuras celulares que contengan clorofila.

Microscopio Confocal Espectral Nikon
Microfluidic culture of rat cortical neurons. At 6 DIV neurons were stimulated with BDNF for 48 hours along with subunit B of Cholera toxin conjugated to alexa 555 (Ctb555; red) and then were immunostained with rabbit anti-MAP2 antibody (green). La imagen fue adquirida con un objetivo 60x.
Autor: Guillermo Moya

Microscopio Confocal Espectral Nikon
Tcf4-positive fibroblasts located in the epimysium of diaphragm
Transverse section through mouse diaphragm muscle shows muscle connective tissue fibroblasts that highly express the transcription factor Tcf4 (green). Individual myofibers are delineated by the basal lamina (red). Peripheral nuclei of individual myofibers and other muscle resident cells are stained blue. Magnificación 400X.
Autor: Osvaldo Contreras. Departamento de Biología Celular, Facultad de Ciencias Biológicas, P. Universidad Católica de Chile.

Microscopio Confocal Espectral Nikon
Triple immunofluorescence staining has been performed in intact (the five upper fibres) and degenerated peripheral nerve fibres (the five lower fibres). The axonal specific marker neurofilament is shown in red, the myelin sheath marker MBP in blue and the Schwann cell cytoplasm in green. Myelin sheath disorganization and axonal fragmentation is seen in 3 days degenerated nerve fibers.
Autor: Sebastian Barrientos and Dr. Felipe Court. Department of Physiollogy, Facultad de Ciencias Biológicas, P. Universidad Católica de Chile

Microscopio Confocal Espectral Nikon
Muestra: Tejido vegetal (Marchantia polymorpha). En rojo cloroplastos, en amarillo citoplasma.
Autor: Ariel Cerda, Laboratorio de Biología Sintética, Centro de Innovación UC, P. Universidad Católica de Chile.

Microscopio Confocal Espectral Nikon
Muestra: Neurona hipocampal de rata (DIV14). RFP en rojo, proteína Cdc42(T17N) en verde y proteína PSD-95 en azul.
Autor: Daniela Vallejo Guerra, Laboratorio de Neurobiologia Molecular, Centro CARE UC, P. Universidad Católica de Chile.

Microscopio Confocal Espectral Nikon
Muestra: Células hipocampales de ratón HT22. En rojo la modificación H3K4me1, en verde el corepresor transcripcional CoREST2 y en azul el núcleo.
Autor: Carlos Rivera Álvarez, Laboratorio de Regulación Epigenética, P. Universidad Católica de Chile.

Microscopio Confocal Espectral Nikon
Muestra: Gema planta Marchantia. Montaje de 4 canales. En cyan se muestra BFP, en amarillo mVenus, en magenta se observa mRUby y en rojo la autofluorescencia de la clorofila. La imagen fue capturada con un 20x.
Autor: Nicole Salgado, UMA-BIO.

Microscopio Nikon Espectral
Muestra: Células epidermales del tejido vegetativo de Arabidopsis thaliana. La imagen corresponde a la proyección de intensidad máxima de un Zstack de la planta de 8 planos, en donde se muestran las células epidermales mediante la tinción de la pared celular con ioduro de propidio. Se puede observar la distribución de los estomas y la heterogeneidad en el área celular del tejido. Las plantas fueron crecidas en una condición suficiente de nitrato por 7 días. Las imágenes fueron adquiridas con un 20x.
Autor: Sebastian Moreno, del Laboratorio Biología de Sistemas de Plantas del Dr. Rodrigo Gutierrez, de la Facultad de Ciencias Biológicas, de la Pontificia Universidad Católica de Chile.
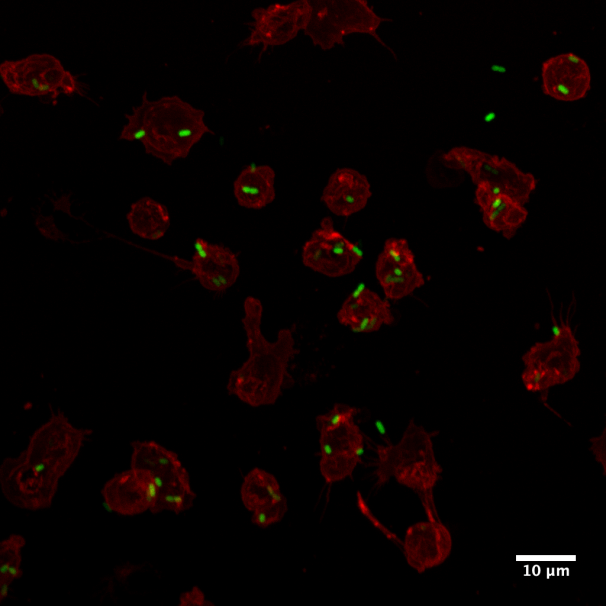
Muestra: Células Ly6G+ derivadas de médula ósea de ratones c57BL/6 wild type infectados con Salmonella enterica serovar Typhimurium delta-spiA. La membrana se encuentra marcada con wheat germ agglutinin, texas red tm-X conjugate y las bacterias con S. Typhimurium 14028 ΔspiA::aph-pkk233.2::egfp.
En la imagen se observa la asociación de S. Typhimurium delta-spiA a la membrana de células Ly6G+ (neutrófilos) 3 horas post infección.
Autor: Bárbara Schultz del Laboratorio de Patogenesis Microbiana, de la Dra. Susan Bueno de la Facultad de Ciencias Biológicas UC.

Microscopio Nikon Espectral
Muestra: Células progenitoras mesenquimales (fibroblastos AKA). En verde se muestra la fibronectina de la matriz extracelular, en azul se muestra el núcleo de las células mientras que en rojo se muestran los filamentos de actina. En la imagen se puede observar la organización de la fibronectina en la matriz extracelular y la organización de los filamentos de actina. La imagen corresponde a la proyección de los máximos de intensidad de cada plano del Zstack. Las imágenes fueron adquiridas con un objetivo 40x.
Autor: Dr. Osvaldo Contreras del Laboratorio de Diferenciación Celular y Patología del Dr. Enrique Brandan, de la Facultad de Ciencias Biológicas UC.

Microscopio Nikon Espectral
Muestra: Corte de 7 um de músculo esquelético de diafragma distrófico de mdx. En rojo se muestra colágeno tipo 1, en verde células PDGFRα–EGFP+. En la imagen se observa que los progenitores fibroadipogénicos (FAP) PDGFRα-EGFP+ se distribuyeron por todo el intersticio muscular según lo la marca de colágeno tipo 1 en el diafragma distrófico. Se observa además acumulación de PDGFRα–EGFPmedium/low-expressing FAPs correspondiente a las áreas enriquecidas con ECM. La imagen corresponde a la proyección de los máximos de intensidad de cada plano del Z-stack. Las imágenes fueron adquiridas con un objetivo 60X.
Autor: Dr. Osvaldo Contreras del Laboratorio de Diferenciación Celular y Patología del Dr. Enrique Brandan, de la Facultad de Ciencias Biológicas UC.
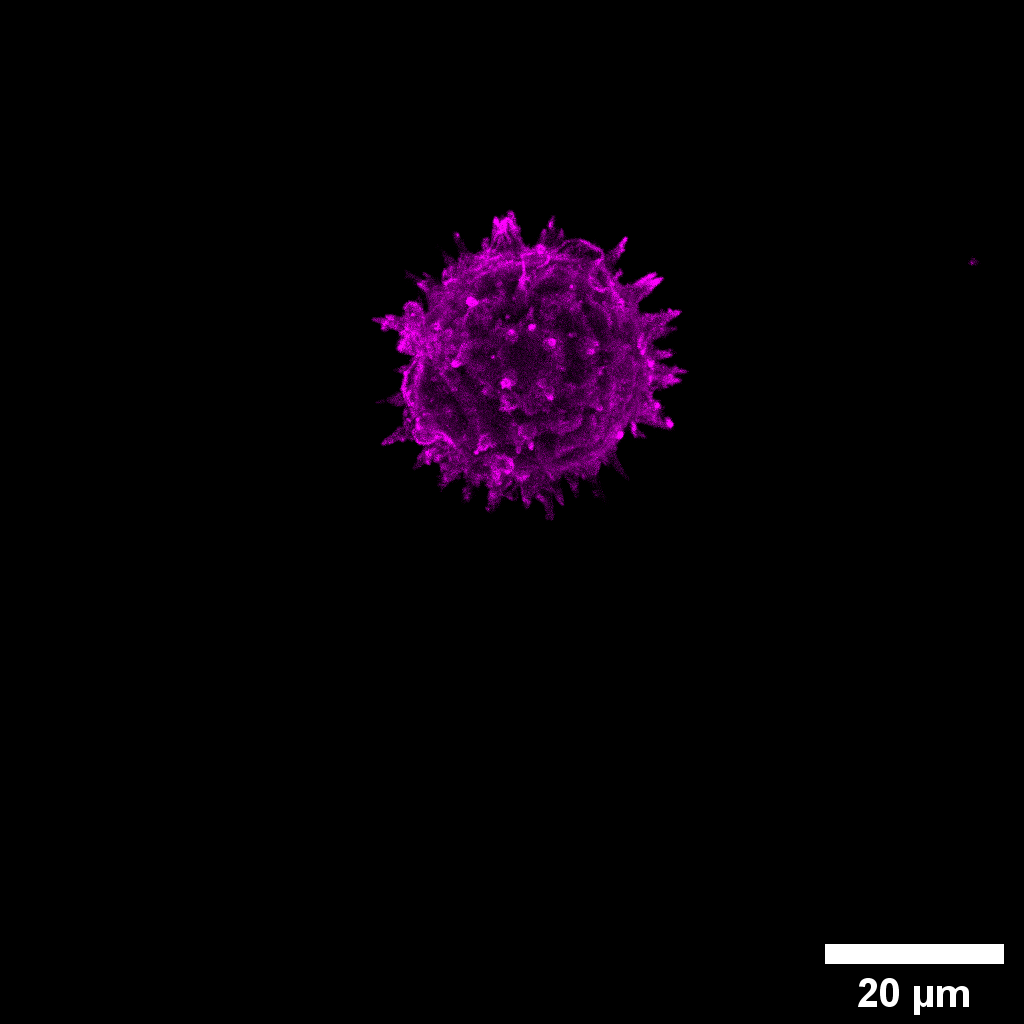
Autofluorescencia Grano de Polen
Reconstrucción 3D de grano de polen. En la imagen se observa la autofluorescencia de grano de polen. Imagen adquirida con un 60x.
Autor: Fernanda Gárate, UMA-BIO, PUC.

















