El microscopio confocal de escaneo láser Nikon C2 es un microscopio ideal para realizar timelaspse de larga duración, pues gracias a la cámara de incubación que tiene es posible mantener las muestras en condiciones óptimas por más de 8 horas. Este equipo cuenta con el sistema Perfect Focus System (PFS) de Nikon, el cual corrige los cambios de focos generados tanto por el drift térmico como el drift mecánico, permitiendo mantener en foco las muestras durante toda la adquisición. Además de adquirir imágenes confocales, en este equipo se puede realizar microscopía widefield, pues incorpora una cámara CMOS que hace posible adquirir imágenes de epifluorescencia convencional y/o imágenes de campo claro. Finalmente, la platina motorizada que tiene este equipo facilita la adquisición de imágenes de muestras de mayor tamaño que el campo de visión, permitiendo obtener información de un campo de visión grande con alta resolución espacial.
|
Microscopio
|
Nikon Ti2-E invertido |
|
Objetivos
|
Plan Apo 10x DIC NA 0.45 |
|
|
Plan Apo 20x DIC NA 0.75 |
|
|
Plan Apo 60x OIL DIC NA 1.40 |
|
|
Plan Apo 100x OIL NA 1.45 |
|
Detección
|
Cámara CMOS ORCA-Flash 4.0 V3 Hamamatsu C13440, tamaño del pixel 6.5 um x 6.5 um |
|
|
PMT C2-DU3 3 |
|
Software
|
NIS-Elements |
|
Otros
|
Platina motorizada modelo Ti2-E de Nikon que incluye además el sistema de mantención del foco PFS (Perfect Focus Systems) |
|
|
Cámara de incubación con control de temperatura, humedad y CO2 |
|
Fuente de luz
|
Láser estado sólido 405 nm |
|
|
Láser estado sólido 488 nm |
|
|
Láser estado sólido 561 nm |
|
|
Láser estado sólido 640 nm |
|
Filtros epifluorescencia
|
DAPI (Ex 350/50 y Em 460/50 nm) |
|
|
GFP (Ex 470/40 y Em 525/50 nm) |
|
|
Texas Red (Ex 560/40 y Em 630/70 nm) |
|
|
Cy5 (Ex 620/50 nm y Em 690/50 nm) |
|
Espejos dicroicos y Filtros de detección confocal
|
Channel 1: C2 V4C EM 445/35 + 660LP (detecta entre 410-480 + LP 660 nm) |
|
|
Channel 2: C2 525/50 [560] 600/50 P2 (488/561) (detecta > 480 y 560 nm) |
|
|
Channel 3: detecta < 560 y 650 nm |
-
Widefield: epifluorescencia convencional y campo claro.
-
Epifluorescencia Confocal.
-
Técnica FRAP (Fluorescence recovery after photobleaching).
-
Análisis de colocalización.
-
Inmunofluorescencia y detección de sondas.
-
Series en Z (z-stack) y reconstrucción 3D.
-
Time-lapse (series temporales) en célula viva.
-
Adquisición de imágenes de mayor tamaño que el campo de visión (Large Image).
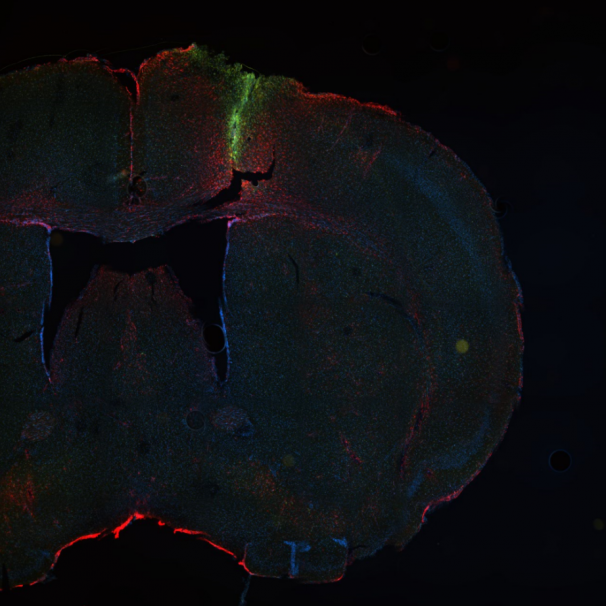
Microscopio Nikon Timelapse
Técnica: la imagen corresponde a la unión (stitching) de varias imágenes adquiridas en microscopía confocal, esta aplicación del microscopio recibe el nombre de Large Image.
Muestra: cerebro de ratón con una inyección control (agua) en la corteza motora (cirugía estereotáxica).
Lo que está marcado en azul corresponde a hoechst, en rojo los astrocitos con marcador GFAP, y en verde microglías con marcador Iba-1.
Autor: Maria Luisa Leon, Laboratorio de Neurobiologia Celular y Regeneración, Departamento de Fisiología, Facultad de Ciencias Biológicas.
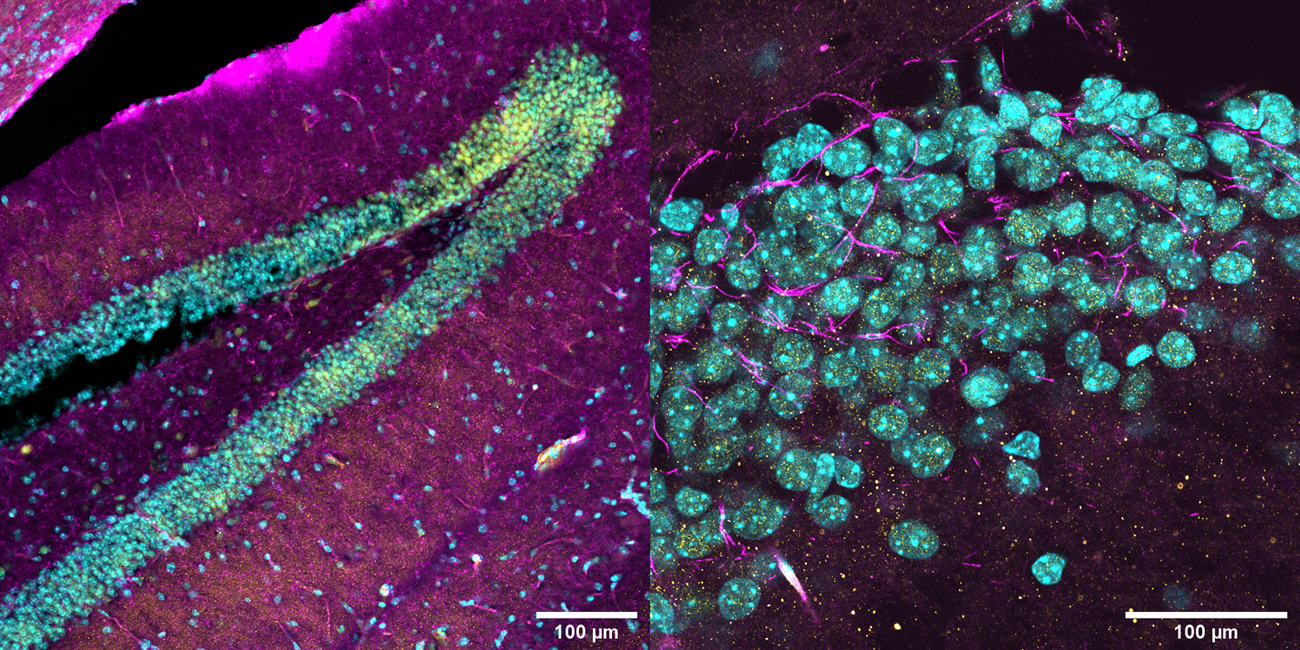
Microscopio Timelapse
Técnica: Microscopía de Expansión y confocal. Muestra: Corte coronal de cerebro de ratón. En las imágenes se observa el giro dentado, estructura que forma parte del hipocampo, en cortes coronales de cerebro de ratón. Se marcaron los núcleos con Hoechst 33342 (marca azul), la proteína tirosina kinasa no receptora Abl1, y βIV spectrin, proteína que forma parte del citoesqueleto periódico del segmento inicial del axón. Se observan muestras preparadas con un protocolo de IF con extracción de antígeno, y también con un protocolo de microscopía de expansión. La microscopía de expansión permite observar con mayor claridad la marca del segmento inicial del axón, e incluso observar el arreglo periódico de βIV spectrin. Ambas imágenes fueron adquiridas con un lente objetivo 20x.
Autor: Cerebros obtenidos y cortados por Tamara Marín PhD. Expansión, inmunofluorescencia, adquisición y procesamiento de imágenes por Nicolás Stuardo. Laboratorio de Señalización Celular (Dra. Alejandra Álvarez)
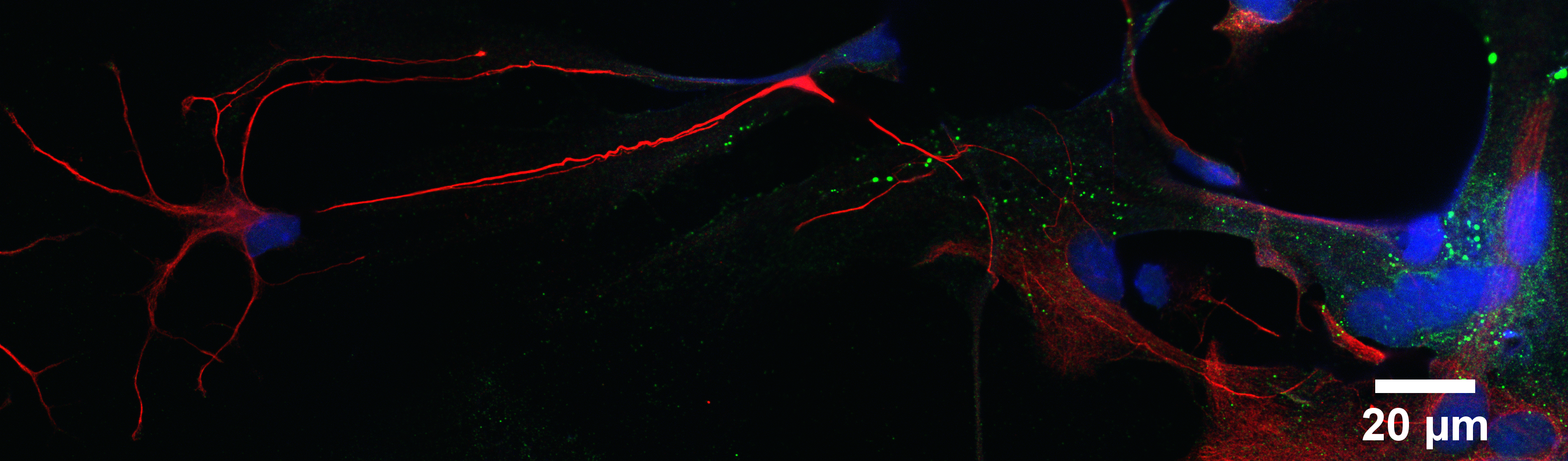
Microscopio Nikon Timelapse
Técnica: la imagen corresponde a la unión (stitching) de varias imágenes adquiridas en microscopía de epifluorescencia convencional (widefield). Esta aplicación del microscopio recibe el nombre de Large Image.
Muestra: Cultivo primario de astrocitos de ratón en inmunofluorescencia indirecta. En la imagen se muestran astrocitos GFAP positivos en rojo (GFAP-555), la presencia de hemicanales de conexina 43, en verde (Cx43 conjugado con Alexa 488) y marca nuclear en azul (Hoechst 33342). Barra de escala = 20um. La imagen fue adquirida con un objetivo 60x.
Autor: Fernanda Gárate, UMA-BIO.
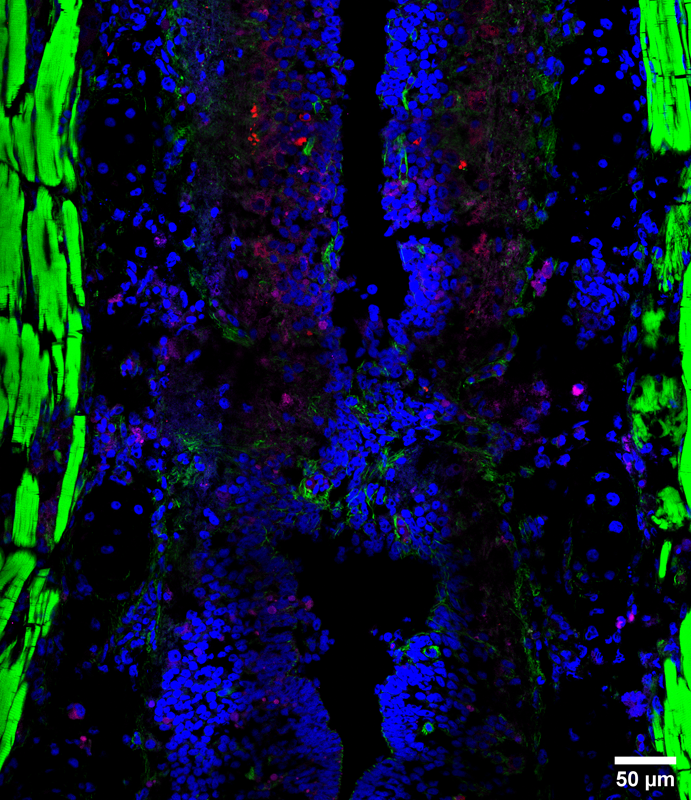
Microscopio Nikon Timelapse
Técnica: Large Image de imágenes confocales adquiridas con un objectivo 60x. Especímen: Región caudal de la médula espinal y cola en proceso de reabsorción de Xenopus laevis estadio 64. En azul se observan los núcleos marcados con Hoescht, en verde está marcada la actina con Phalloidin 488 y en rojo Caspasa-3 activada.
Autor: Paula Slater del Laboratorio de Biología del Desarrollo y Regeneración, Facultad de Ciencias Biológicas, Pontificia Universidad Católica de Chile.
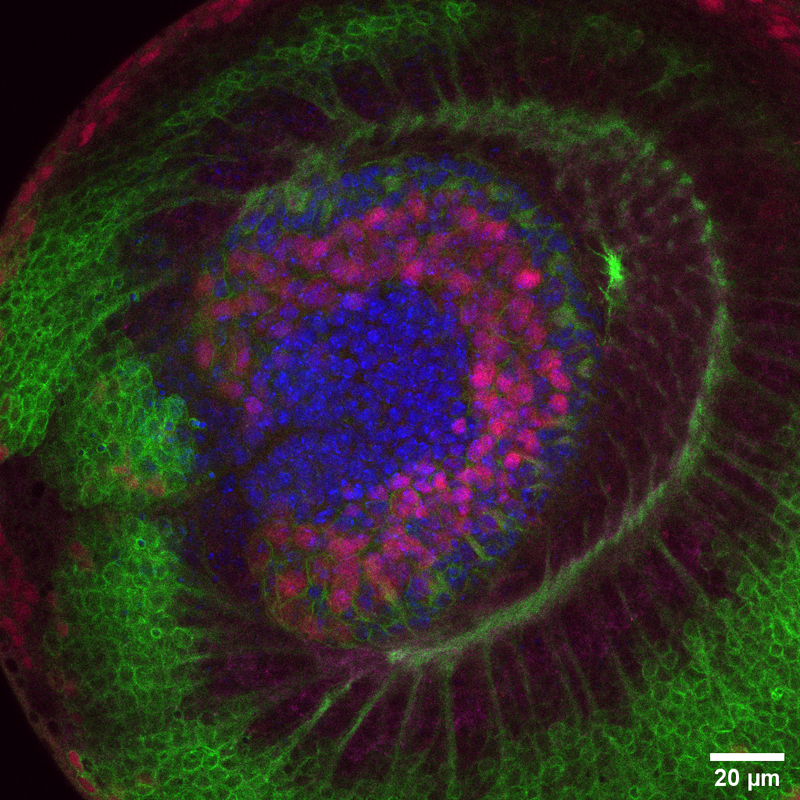
Microscopio Nikon Timelapse
Técnica: microscopía confocal. Espécimen: lóbulo óptico Drosophila. En verde se muestran Neuronas Eyless, en azul Dapi, en rojo Deadpan (factor de transcripción de neuroblastos) y en magenta Ncaderina.
Autor: Constanza Gonzalez, Laboratorio de Neurodesarrollo, Facultad de Ciencias Biológicas, Pontificia Universidad Católica de Chile. Imagen ganadora del concurso de fotografía "Captura La Ciencia 2019".
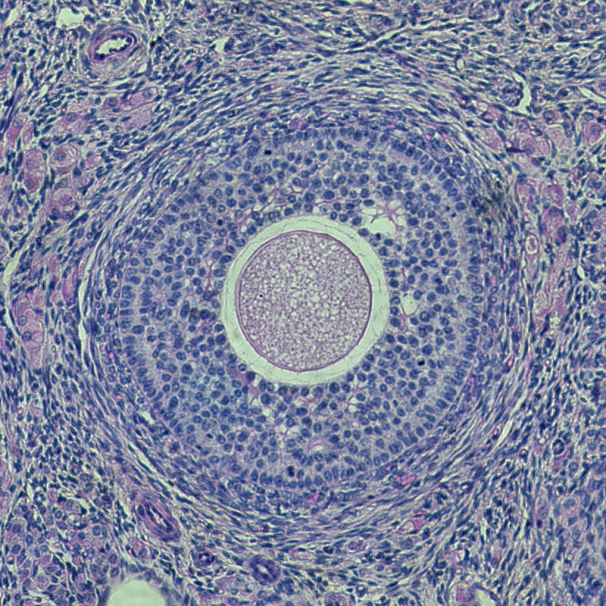
Microscopio Nikon Timelapse
Técnica: Imagen campo claro con filtros para obtener imagen a color. Muestra: Tejido de ovario de coneja con tinción de hematoxilina-eosina.
Autor: Fernanda Gárate, UMA-BIO.











