El microscopio LSM 880 de ZEISS con detección Airyscan es un microscopio confocal de escaneo láser que puede adquirir imágenes bajo el límite de resolución (resolución lateral ~120 nm y axial ~350 nm). Los detectores que conforman este microscopio son altamente sensibles haciendo posible la adquisición de imágenes de superresolución a alta velocidad. Además del detector Airyscan, el equipo cuenta con 4 detectores más: el detector espectral GaAsp, dos PMT y un detector de luz transmitida (T-PMT). Mediante el detector espectral es posible adquirir el espectro de emisión de distintos fluoróforos lo que permite separar la emisión de dos o más fluoróforos cuyos espectros se encuentren cercanos entre sí. Empleando este detector en conjunto con los detectores PMT es posible adquirir simultáneamente hasta 10 canales. Además, las imágenes de campo claro adquiridas con el detector de luz transmitida pueden ser contrastadas con su correspondientes imágenes confocal. Gracias a la cámara de incubación y la rápida adquisición, este microscopio resulta ideal para adquirir imágenes de muestras vivas, para realizar timelapse de larga duración o z-stacks de muestras grandes. Finalmente, la platina motorizada que tiene este equipo facilita la adquisición de imágenes de muestras de mayor tamaño que el campo de visión, permitiendo obtener información de un campo de visión grande con alta resolución espacial.
|
Microscopio
|
LSM 880 ZEISS con detección Airyscan |
|
Objetivos
|
Plan-Apochromat 10x NA 0.45 |
|
|
Plan-Apochromat 20x NA 0.80 |
|
|
Plan-Apochromat 40x NA 1.20 Water, Silicone oil and Glycerine Correction, DIC |
|
|
Plan-Apochromat 63x NA 1.40 Oil DIC |
|
Detección
|
Detector espectral de 32 canales GaAsP PMT |
|
|
2 detectores MA-PMT |
|
|
Detector de luz transmitida T-PMT |
|
|
Detector Airyscan |
|
Software
|
ZEN 2.3 Black |
|
|
ZEN Blue |
|
Otros
|
Platina motorizada |
|
|
Cámara de incubación XLmulti S PECON que controla temperatura, humedad y CO2 |
|
|
Sistema Definite focus 2 |
|
Fuentes de luz
|
Lámpara de Mercurio HXP 120V |
|
|
Lámpara Halógena 100 W |
|
|
Láser diodo 405 (30 mW) |
|
|
Láser Argón multilínea 458/488/514 |
|
|
Láser DPSS 561 |
|
|
Láser HeNe 633 |
|
Filtros
|
Set de filtros 38 GFP (EX 470/40 y EM 525/50) |
|
|
Set de filtros 43 Cy3 (EX 545/25 y EM 605/70) |
|
|
Set de filtros 43 DAPI (EX 365 y EM 445/50) |
|
|
Filtro de emisión BP 420-480 + BP 495-550 Airyscan |
|
|
Filtro de emisión BP 495-550 + LP 570 Airyscan |
|
|
Filtro de emisión BP 570-620 + LP 645 Airyscan |
|
|
Filtro de emisión BP 420-480 + BP 495-620 Airyscan |
|
|
Filtro de emisión BP 420-480 + LP 605 Airyscan |
|
|
Filtro de emisión BP 465-505 + LP 525 |
|
Main Beam Splitter Luz Visible
|
458 |
|
|
458/514 |
|
|
458/561 |
|
|
458/514/594 |
|
|
488 |
|
|
488/561 |
|
|
488/594 |
|
|
488/561/633 |
|
Main Beam Splitter Luz Invisible
|
405 |
|
|
445 |
-
Adquisición luz transmitida, confocal y superresolución.
-
Determinación de espectros de fluorescencia y separación espectral.
-
Técnica DIC (Differential interference contrast or Nomarski interference contrast).
-
Técnica FRAP (Fluorescence Recovery After Photobleaching).
-
Técnica FLIP (Fluorescence Loss in Photobleaching).
-
Técnica FRET (Fluorescence Resonance Energy Transfer).
-
Análisis de colocalización.
-
Inmunofluorescencia y detección de sondas.
-
Series en Z (z-stack) y reconstrucción 3D.
-
Time-lapse (series temporales) en célula viva.
-
Reconstrucción 2D (Tile scan).
-
Dinámica Celular.
-
Desarrollo embrionario.
-
Técnica IRM (Interference reflection microscopy).
-
Fotoactivación y fotoconversión.
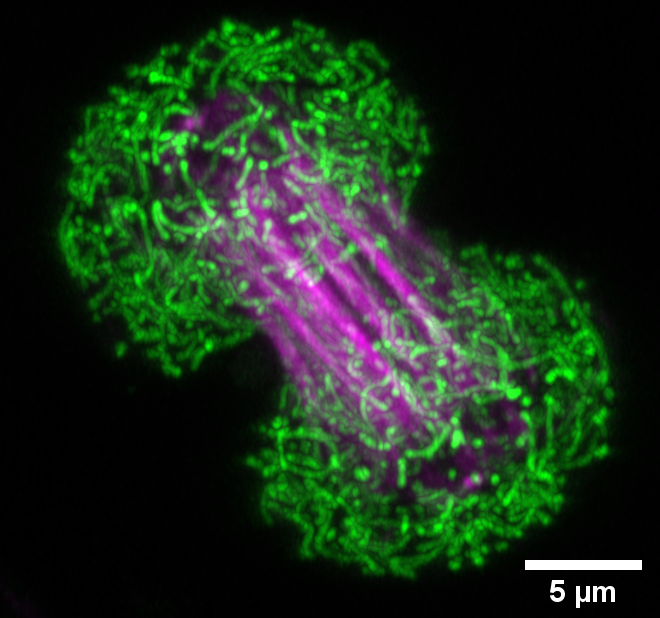
Interacción entre mitocondrias y microtúbulos en células musculares vivas durante mitosis
Técnica: Confocal con detección Airyscan Fast.
Muestra: Línea celular de músculo c2c12. En la imagen se observa en verde mitocondria marcada con Mitotracker green y en magenta microtúbulos marcados con SirTubulin.
Autor: Mauricio Castro/ Ana Maria Figueroa/ Juan gutierrez del Laboratorio de Fisiología del Ejercicio y Metabolismo (LABFEM), Escuela de Kinesiologia, Facultad de Medicina, Universidad Finis Terrae, Santiago, Chile.

Microscopio Zeiss Airyscan
Técnica: Confocal con detección espectral.
Muestra: Corte de cerebro de larva de mosca D. melanogaster. En verde se observa Expresión de CD4::tdTomato. En magenta se observa FasII (FasII es una proteína de adhesión neuronal altamente expresada en el cuerpo fungiforme de Drosophila melanogaster) y en azul núcleos marcados con DAPI.
Autor: Francisca Rojo Cortés, tesis bajo la supervisión de los académicos María Paz Marzolo y Jorge Campusano en los laboratorios de Tráfico Intracelular y Señalización, y de Neurogenética de la Conducta, de la Facultad de Ciencias Biológicas de la Pontificia Universidad Católica de Chile. Esta imagen corresponde a un plano de un Z-stack que fue premiado por la Sociedad de Biología Molecular de Chile como la mejor imagen en la categoría Biología Celular y Molecular.

Microscopio Zeiss Airyscan
Técnica: Confocal.
Muestra: Corte de tejido de cerebro de larva de tercer estadio Drosophila melanogaster de la cruza Elav-GAL4 x Repo-GAL4, UAS-mCD8GFP. El corte tiene un grosor de 100 um aproximádamente. En azul hoeschst, en verde mCD8-GFP gliales y neuronales, en rojo: Repo (Factor de transcripción glial) y en magenta Elav (factor de transcripción neuronal). La imagen fue adquirida con un objetivo 20x.
Autor: Constanza Gonzalez, Laboratorio de Neurodesarrollo, Facultad de Ciencias Biológicas, Pontificia Universidad Católica de Chile.
Esta imagen se encuentra en un paper que esta en revisión (Lorena Caipo, et al, 2019).

Microscopio Zeiss Airyscan
Técnica: Confocal y Z-stack.
Muestra: Corte de tejido de cerebro de larva de tercer estadio Drosophila melanogaster de la cruza Elav-GAL4 x Repo-GAL4, UAS-mCD8GFP. El corte tiene un grosor de 100 um aproximádamente. En azul hoeschst, en verde mCD8-GFP gliales y neuronales, en rojo: Repo (Factor de transcripción glial) y en magenta Elav (factor de transcripción neuronal). Las imágenes fueron adquiridas con un objetivo 20x.
Autor: Constanza Gonzalez, Laboratorio de Neurodesarrollo, Facultad de Ciencias Biológicas, Pontificia Universidad Católica de Chile.
Esta imagen se encuentra en un paper que esta en revisión (Lorena Caipo, et al, 2019).

Microscopio Confozal Zeiss Airyscan
Técnica: la imagen corresponde a la unión (stitching) de varias imágenes adquiridas en microscopía confocal. Cada imagen fue adquirida con un objetivo 10x. Esta aplicación del microscopio recibe el nombre de Tile Scan.
Especímen: Pez cebra, 37 días de edad. En rojo: Alizarin Red.
Autor: Nicolás Cumplido, Laboratorio de Miguel Allende, Biología del Desarrollo, Facultad de Ciencias, Universidad de Chile.

Microscopio Zeiss Airyscan
Muestra: Hoja Arabidopsis Thaliana. En cian se observa el núcleo de la célula marcado con mTFP y en amarillo se observa la membrana celular marcada con mCitrine.
Técnica: La imagen de la izquierda corresponde a un Tile Scan y proyección de los máximos de intensidad de un Z-stack de imágenes adquiridas con un objetivo 10x. La imagen de la derecha es un zoom de la imagen de la izquierda en donde se puede apreciar en detalle las células epidérmicas de la hoja.
Autor: Brenda Riquelme, Laboratorio de Biología Molecular y Biogecnología Vegetal, Facultad de Ciencias Biológicas, Pontificia Universidad Católica de Chile.

Microscopio Zeiss Airyscan
Muestra: Kerarinocitos humanos.
Montaje que muestra imágenes de una muestra adquiridas con distintas técnicas, todas ellas implementadas en el microscopio Airyscan. Estas técnicas son: microscopía diferencial de contraste de interferencia (DIC), microscopía de reflexión de interferencia (IRM) y microscopía confocal. En azul se muestran los núcleos de las células marcados con Dapi. Las imágenes fueron adquiridas con un 63x.
Autor: Fernanda Gárate, UMA -BIO, PUC.

Microscopio Zeiss Airyscan
Muestra: Linfocitos B (linea IIA1.6). En verde se muestra actina (sonda Phalloidin 647) mientras que en rojo se observa la cadena liviana de miosina II (MLC Myosin Light chain II + 2dario Cy3). En la imagen se observa la vista ortogonal del plano de la sinapsis inmune de Linfocitos B activados durante 1h sobre una superficie de vidrio (coverslips) recubierta con antígeno. En la inmunofluorescencia se destaca la presencia de MLC (rojo) y Actina (verde).
Autor: Danitza Fuentes, PhD (c) del programa de doctorado Ciencias Biológicas mención Biología Celular y Molecular y del laboratorio de biología celular inmune, de la Facultad de Ciencias Biológicas de la PUC.

Microscopio Zeiss Airyscan
Muestra: MCF7 (Cáncer de mama). En verde se observa Alexa fluor 488 ( LSD1), en rojo Alexa fluor 594 (SRSF2) y en azul Dapi (DNA). La imagen corresponde a un análisis de inmunofluorescencia en células MCF7 en donde se observa la localización de las proteínas LSD1 (Regulador de la expresión génica) y SRSF2( Marcador de Speckles nucleares) en líneas celulares de cáncer de mama. De igual manera se establece su localización a nivel celular empleando DAPI como marcador de DNA o cromatina(azul).
Autor: Daniel E Verbel V del laboratorio de regulación neuroepigenética de la Facultad de Ciencias Biológicas de la PUC.

Microscopio Zeiss Airyscan
Muestra: neuronas de corteza de ratón de 18 DIV transfectadas con cAbl-GFP. Técnica: FRAP. En la imagen se puede observar la localización ubicua de la proteína cAbl, tanto en el soma como en las dendritas de la neurona. El montaje muestra 3 etapas del proceso de FRAP. Una neurona es fotoblanqueada a los 5 s en la zona indicada por el cuadrado blanco, la primera imagen es antes de del fotoblanqueamiento, la del centro es una captura en el momento del fotoblanqueamiento y la última es un registro 20 s después del fotoblanqueamiento. Mediante esta técnica se puede estudiar la recuperación de la marca en la zona.
Autor: Daniela Gutierrez Garcia del laboratorio de la Dra. Alejandra Álvarez Rojas, Señalización celular, CARE, de la Facultad de Ciencias Biológicas de la PUC.

Microscopio Zeiss Airyscan
Muestra: Ovocito maduro de ratón fijado y montado en Fluoromont G. En azul se observa filipina, agente fluorescente que se une a colesterol no esterificado. En verde se muestra inmunodetección de LAMP-1, proteína de membrana lisosomal.
En la imagen se puede observar la colocalización subcelular en un ovocito de ratón de colesterol libre, mediante la tinción con filipina (azul), y lisosomas, a través de inmunofluorescencia usando anti-LAMP-1 (verde).
Autor: Andreina Arias del Laboratorio de Nutrición, Metabolismo y Reproducción, Centro de Investigación e Innovación Biomédica, Universidad de Los Andes.

Microscopio Confocal Airyscan
Técnica: Microscopía Airyscan Fast. Muestra: Células de riñón canino de Madin-Darby (MDCK) . En la imagen se observa la organización del citoesqueleto de actina en células epiteliales (MDCK) sobre sustrato blando (16KPa) funcionalizado con fibronectina. Cadena ligera reguladora de la miosina (RLC) -GFP (verde) - Phalloidina 555 (rojo) - E-cadherina rojo lejano (647).
Autor: Pablo Aceiton. (Estudiante Doctorado Ciencias Biológicas Mención Ciencias Fisiológicas

















