El microscopio Nikon TIRF está conformado por el microscopio invertido NIKON Eclipse Ti2-E y el módulo NIKON H-TIRF. La incorporación de este módulo al microscopio invertido permite implementar la técnica TIRF (Total Internal Reflection Fluorescense) de manera simple, debido a que la alineación del láser está automatizada. Este microscopio se destaca principalmente por la resolución axial que alcanza al implementar la técnica TIRF. La resolución axial que se puede alcanzar mediante TIRF (entre 100 – 200 nm) es 5 veces mayor que la resolución que se puede lograr con un microscopio confocal convencional. Dado que en este microscopio es posible realizar epifluorescencia convencional e iluminación diascópica (luz transmitida), las imágenes TIRF pueden ser contrastadas con sus correspondientes imágenes de epifluorescencia o con su imagen de campo claro. El sistema tiene distintos láseres y filtros, lo que permite realizar TIRF en muestras marcadas con distintos fluoróforos. Este equipo cuenta con la cámara iXon 897, que tiene un detector EMCCD. Este detector ultrasensible permite capturar imágenes a alta velocidad (hasta 150 FPS) incluso de muestras que emiten poca luz. Esta cámara en conjunto con el módulo TIRF le otorgan al sistema las características más demandadas para realizar experimentos de microscopía fluorescente de molécula individual, debido al balance que existe entre la resolución espacial y temporal en condiciones de poca luz. Adicionalmente, el microscopio tiene el sistema OptoSplitt II, el cual permite la visualización simultánea de distintos canales, aumentando aún más la resolución temporal del equipo. Esta característica resulta ventajosa para aplicaciones como FRET. Finalmente, este microscopio incorpora también un módulo para la realización FRAP (Fluorescence Recovery After Photobleaching).
|
Microscopio
|
Nikon modelo Eclipse Ti2-E (invertido) |
|
Sistema TIRF motorizado
|
Nikon módulo Ti2-LA-H-TIRF |
|
Sistema EpiFluorescencia
|
Nikon módulo Ti2-LA-FL |
|
Sistema FRAP
|
Nikon módulo Ti2-LA-FRAP |
|
Andor OptoSplit II
|
Incluye cubos para CFP/YFP y TIRF 488/561 |
|
Objetivos
|
Plan Apo 20x NA 0.75 |
|
|
Plan Fluor 40x OIL NA 1.30 |
|
|
Apo TIRF 60x DIC OIL NA 1.49 |
|
|
SR HP Apo TIRF 100x OIL NA 1.49 |
|
Detección
|
EMCCD Andor iXon 897, tamaño pixel 16 um x 16 um |
|
|
Cámara a color Nikon DS-FI2, 5.24 megapixels |
|
Software
|
NIS-ELEMENTS AR |
|
Otros
|
Platina motorizada modelo Eclipse Ti-E de Nikon que incluye además el sistema de mantención del foco PFS (Perfect Focus Systems) |
|
|
Platina de incubación con control de temperatura, humedad y CO2 |
|
Fuente de luz
|
Láser estado sólido 405 nm (100 mW) |
|
|
Láser estado sólido 445 nm (45 mW) |
|
|
Láser estado sólido 488 nm (100 mW) |
|
|
Láser estado sólido 514 nm |
|
|
Láser estado sólido 561 nm (80 mW) |
|
|
Lámpara de XENÓN LAMBDA DG-4 Plus |
|
Cubos de fluorescencia
|
DAPI (Ex 375/28 nm y Em 460/50 nm) |
|
|
GFP (Ex 488/30 nm y Em 535/40 nm) |
|
|
Cherry (Ex 540/25 nm y Em 620/60 nm) |
|
|
Cy5 (Ex 620/50 nm y Em 690/50 nm) |
|
|
Filtros TIRF: Quad (Ex 405/488/561/638 nm y Em 420-480/500-550/580-620/650-750 nm) |
|
|
Set filtros FRET cubo dual CFP/YFP (Ex 442/514 nm y Em 460-500/530-610 nm) |
|
|
Set filtros FURA-2 (Ex 340/380 nm y Em 510/80 nm) |
-
Medición de concentración de calcio mediante FURA-2.
-
Técnica DIC (Differential interference contrast or Nomarski interference contrast).
-
Técnica FRAP (Fluorescence Recovery After Photobleaching).
-
Técnica FLIP (Fluorescence Loss in Photobleaching).
-
Técnica FRET (Fluorescence Resonance Energy Transfer) a alta velocidad.
-
Técnica TIRF (Total Internal Reflection Fluorescence).
-
Epifluorescencia convencional.
-
Molécula Individual.
-
Luz polarizada.
-
Reconstrucciones histológicas.
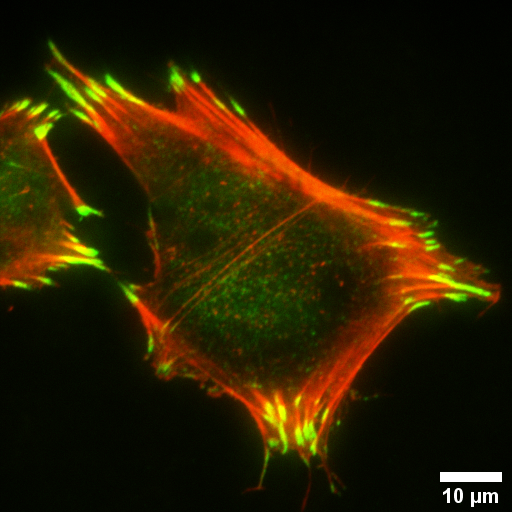
Microscopio Nikon TIRF
Técnica: TIRF. Tipo celular: fibroblastos gingivales humanos, cultivo primario.
En verde se observa Integrina beta1-Alexa marcada con Alexa Fluor 488 y en rojo se observa Actina del citoesqueleto marcada con Faloidina. Mediante la técnica TIRF es posible identificar los contactos focales de integrina beta1 en fibroblastos gingivales humanos estimulados con TGF-beta durante proceso de expansión celular (spreading).
Autor: Leticia Rojas y Dr. Patricio Smith del Laboratorio de Odontología UC.
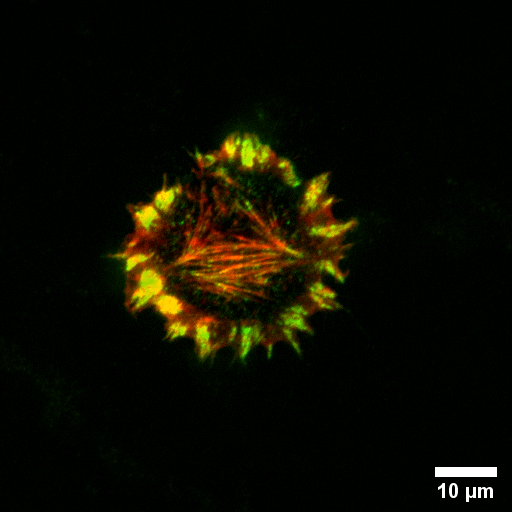
Microscopio Nikon TIRF
Técnica: TIRF. Tipo celular: fibroblastos gingivales humanos, cultivo primario.
En verde se observa Integrina beta1-Alexa marcada con Alexa Fluor 488 y en rojo se observa Actina del citoesqueleto marcada con Faloidina. Mediante la técnica TIRF es posible identificar los contactos focales de integrina beta1 en fibroblastos gingivales humanos estimulados con TGF-beta durante proceso de expansión celular (spreading).
Autor: Leticia Rojas y Dr. Patricio Smith del Laboratorio de Odontología UC.
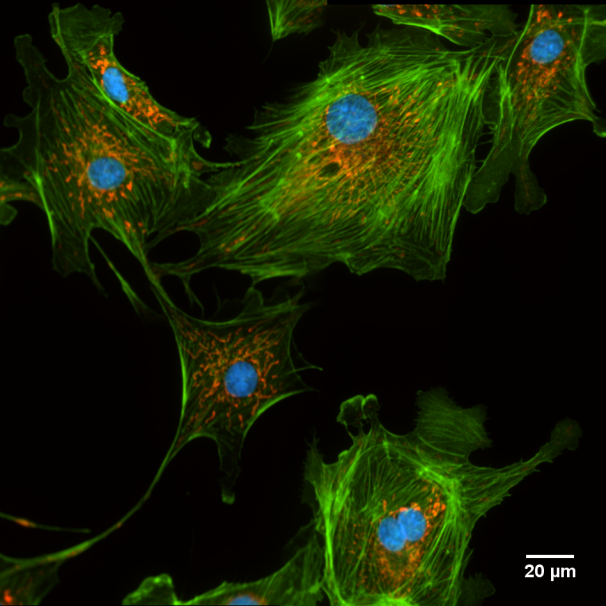
Microscopio Nikon TIRF
Técnica: Epifluorescencia.
Muestra: Cultivo de células epiteliales de la arteria pulmonar de bovino. En rojo están marcadas las Mitocondrias (Mitotracker Red CMXRos), en verde la actina (Alexa fluor 488 - Phalloidin) y en azul el núcleo (DAPI). La imagen fue adquirida con un objetivo 60x.
Autor: Fernanda Gárate, UMA-BIO.
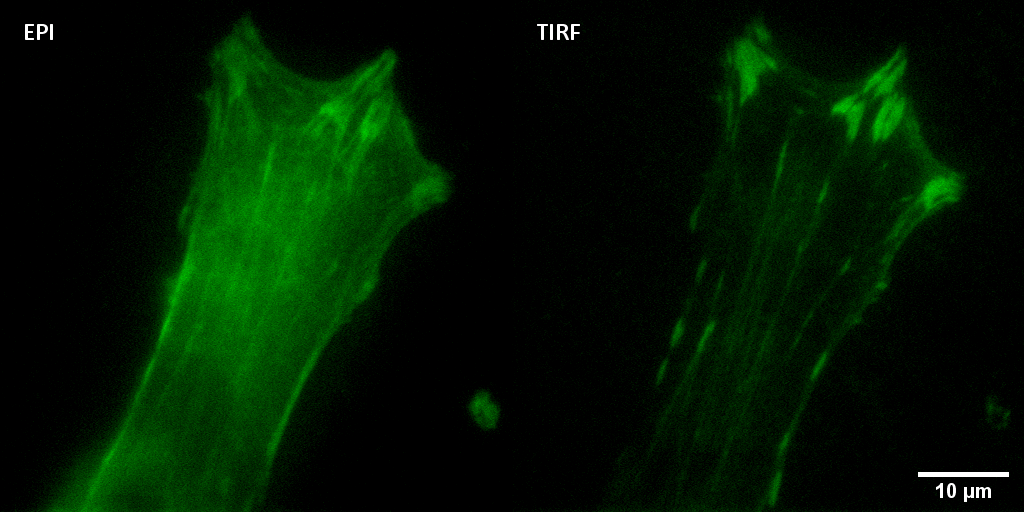
Microscopio Nikon TIRF
Figura que compara la técnica Epifluorescencia convencional (imagen izquierda) con la técnica TIRF (imagen derecha) para visualizar puntos de adhesión focal sobre un film de colágeno tipo I.
Especímen: Cultivo primario de fibroblastos gingivales. En verde se muestra Vinculina. La imagen fue adquirida con un objetivo 100x.
Autores: Javier Espinoza y Shuheng Lai, del Laboratorio de
Investigación Odontología, Dr. Patricio Smith, Escuela de
Odontología UC.
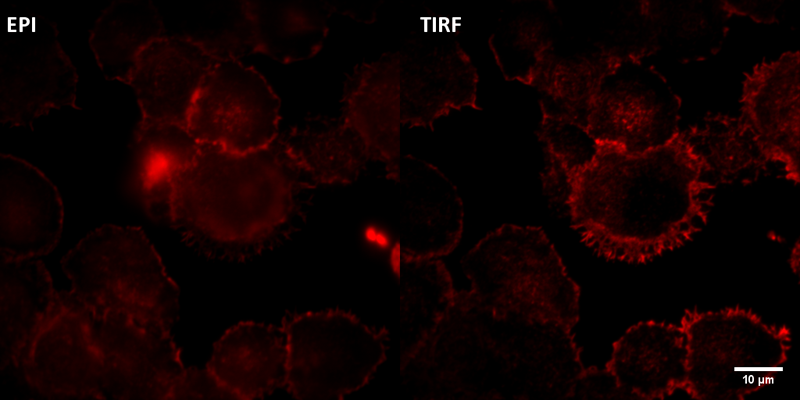
Microscopio Nikon TIRF
Figura que compara la técnica Epifluorescencia convencional (imagen izquierda) con la técnica TIRF (imagen derecha) para visualizar filamentos de actina. La muestra corresponde a Linfocitos B, línea celular A20, fijados y montados en fluormount G. Los filamentos de actina se encuentran teñidos con faloidina. La imagen fue adquirida con un objetivo 100x.
Autor: Fernanda Gárate, UMA-BIO.
Muestra proporcionada por Jheimmy Díaz, Investigador Adjunto del Laboratorio de Comunicación y Función de Células del Sistema Inmune, Facultad de Ciencias Biológicas, Pontificia Universidad Católica de Chile.

Microscopio Nikon TIRF
Técnica: Large image en campo claro y epifluorescencia.
Muestra: corte de hígado de ratón, marcado con tinción histológica hematoxilina-eosina.
Descripción de la imagen: la figura muestra un montaje de 4 imágenes adquiridas con el microscopio TIRF empleando el modo Large Image. La imagen superior corresponde a un zoom de la imagen de campo claro. Las dos imágenes inferiores fueron adquiridas en epifluorescencia y corresponden al canal verde y rojo. Barra de escala superior = 100 um e inferior = 1 mm. La imagen fue adquirida con un objetivo 20x.
Autor: Fernanda Gárate, UMA-BIO.
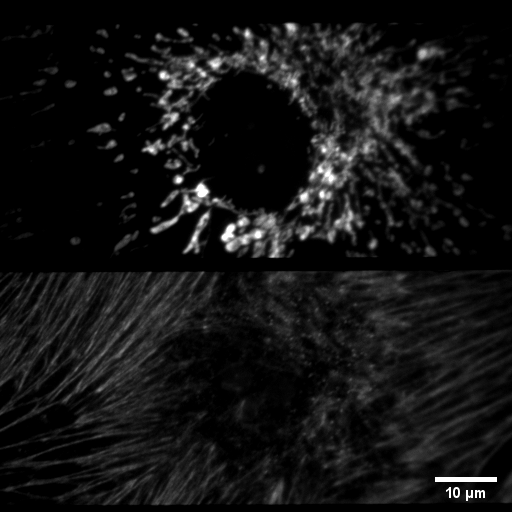
Microscopio Nikon TIRF
Imagen que muestra la función del OptoSplit II. Este sistema permite capturar dos canales simultáneamente, en este caso señal roja y verde. La mitad superior del sensor de la cámara EMCCD captura señal roja, mientras que la otra mitad captura señal verde. Técnica: Epifluorescencia.
Muestra: Cultivo de células epiteliales de la arteria pulmonar de bovino. En la parte superior se muestran las Mitocondrias marcadas con Mitotracker Red CMXRos y en la parte inferior se muestra la actina marcada con Alexa fluor 488. La imagen fue adquirida con un objetivo 100x.
Autor: Fernanda Gárate, UMA-BIO.
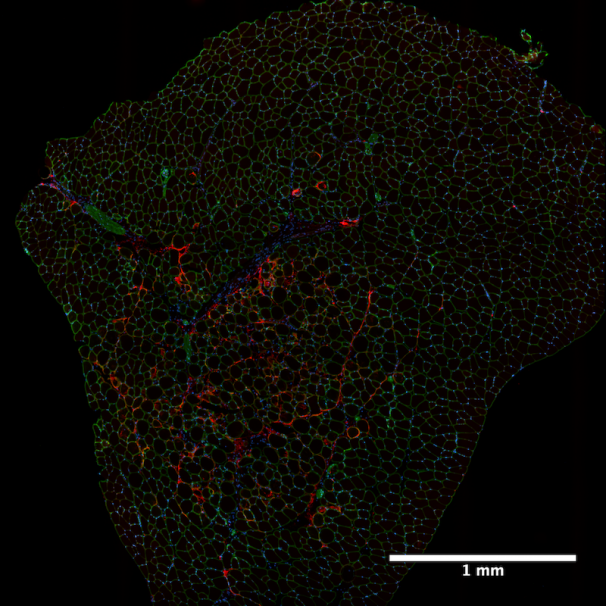
Microscopio Nikon TIRF
Muestra: Criosección de 10 micras de músculo skelético tibialis anterior de ratón. En azul se muestran los núcleos marcados con Hoechst 33342, en verde laminina (alexa 488) y en rojo CTGF/CCN2 (alexa 568). Técnica: Epifluorescencia convencional y reconstrucción 2D (large image). En la imagen se observa la inducción de la expresión de CTGF/CCN2 en músculo esquelético luego de una inyección intramuscular de rhTGF-b y activación farmacológica sistémica de la ruta de señalización de hipoxia (DMOG). Cada imagen fue adquirida con un objetivo 10x. Esta imagen fue publicada en Valle-tenney et al., 2019, “Role of hypoxia in skeletal muscle fibrosis: Synergism between hypoxia and TGF-β signaling upregulates CCN2/CTGF expression specifically in muscle fibers,” Matrix Biology. https://doi.org/10.1016/j.matbio.2019.09.003.
Autor: Roger Valle-Tenney, del laboratorio de Diferenciación Celular y Patología.

Microscopio Nikon TIRF
Muestra: Linfocitos B, línea celular A20. Técnica: DIC. En la imagen se puede observar la adhesión celular de linfocitos B bajo activación en cubreobjetos de vidrio.
Autor: Fernanda Cabrera del Laboratorio de Comunicación y Función de las Células Inmunes del Departamento de Biología Celular y Molecular de la Facultad de Ciencias Biológicas UC.














